Juures Päästetee biomolekula lagunemissaadustest sünteesitakse uus biomolekul. Päästekäiku nimetatakse ka taastumisteeks ja see on nii-öelda metabolismis taaskasutamise vorm.
Mis on päästetee?
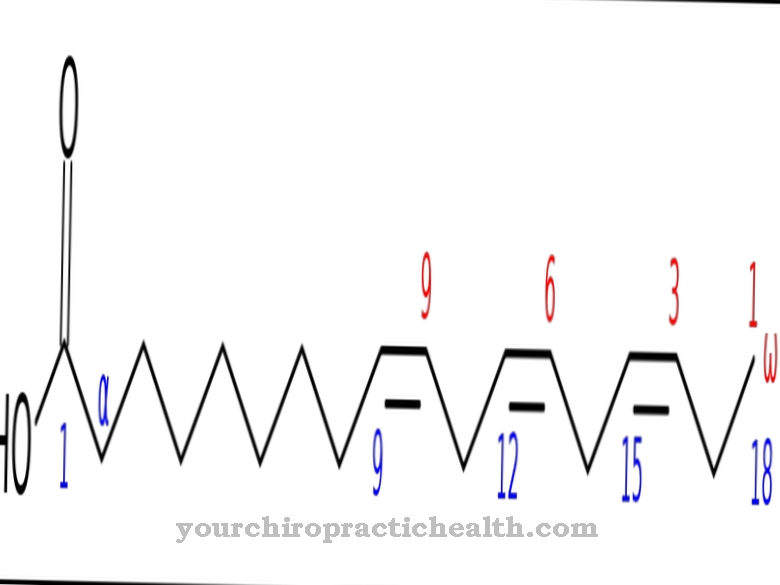
Päästekäik tähistab ühelt poolt selle ringlussevõtu üldist vormi metabolismis ja teiselt poolt puriinide nukleotiidide metabolismirada. Puriini nukleotiidid on desoksüribonukleiinhappe (DNA) ja ribonukleiinhappe (RNA) põhilised keemilised ehitusplokid.
Putini nukleotiidide päästmisel moodustuvad mononukleotiidid puriini alustest guaniinist, adeniinist ja hüpoksantiinist. 90% -l on see metaboolne rada vabade puriinide peamine metabolismirada. Ülejäänud osa jaotatakse kusihappeks. Päästekäigul on mitmeid eeliseid, eriti võrreldes puriinmononukleotiidide de novo biosünteesi. Näiteks on see märkimisväärselt energiatõhusam.
Anatoomia ja struktuur
Bitsükliliste puriinaluste süntees nõuab keha jaoks palju pingutusi. Seetõttu jaotatakse need lihtsateks alusteks ja kasutatakse siis uuesti.
Ringlussevõtu teel kasutatakse sünteesireaktsioonides erinevaid mononukleotiidide, nukleosiidide, polünukleotiidide või nukleiinhapete aluste lagunemise vaheprodukte, selle asemel, et neid täielikult lagundada. Päästetee kaudu toimuva reaktsiooni kaudu saab metabolismi kasulikke ja väärtuslikke vaheprodukte, nn metaboliite, päästa jäätmetest. Seega ei pea neid metaboliite uuesti tootma. See protsess säästab raku suurt energiakulu. Päästekäigul kantakse fosforibosüülpürofosfaadist (PRPP) pärit riboosfosfaat vaba puriini alusesse.
Nukleotiid moodustatakse pürofosfaadi eraldamisel. Selleks vajalikud ensüümid aktiveeritakse fosforibosüülpürofosfaadi poolt ja inhibeeritakse lõpptoodete poolt. Puriini aluse adeniinist koos (PRPP) ja ensüümi adeniini fosforibosüültransferaasi (APRT) abil moodustub adenosiinmonofosfaat (AMP). Seoses PRPP ja ensüümiga hüpoksantiin-guaniin-fosforibosüültransferaas (HGPRT) muutub guaniin nukleotiidseks guanosiinmonofosfaadiks (GMP). Koos PRPP ja ensüümi hüpoksantiin-guaniin-fosforibosüültransferaasiga muutub hüpoksantiin nukleotiidide inosiinmonofosfaadiks (IMP).
Muud päästmisprotsessis osalevad ensüümid on nukleosiidfosforülaasid, nukleosiidi kinaasid ja nukleotiidide kinaasid. 90% puriinidest muundatakse kõigepealt nukleotiidideks ja muundatakse seejärel muundamise teel taas nukleiinhapete sünteesiks. 10% puriinidest lagundatakse kusihappeks ja eritub neerude kaudu.
Funktsioon ja ülesanded
Päästekäik toimub peaaegu kõigis keha rakkudes, kuna puriinid lagunevad peaaegu kõigis keha rakkudes. Puriinid kuuluvad heterotsüklite rühma ja on pürimidiinide kõrval kõige olulisemad nukleiinhapete ehitusplokid. Puriinide moodustamiseks kasutatakse päästerada ise. Need sisalduvad kõigis tuuma sisaldavates rakkudes.
Loomset päritolu toit, eriti rups ja nahk, sisaldavad palju puriine. Puriinid, mida päästetee kaudu ringlusse ei võeta, lagundatakse kusihappeks ja erituvad neerude kaudu. Päästekanalüüsil ei ole vereväärtusi, kuid kusihape on olemas. Meestel on kusihappe sisaldus veres tavaliselt 3,4–7,0 mg / 100 ml. Naistel peaks kusihappe väärtus olema vahemikus 2,4–5,7 mg / l.
Haigused
Kui päästeteel on puudusi, ei saa puriine enam ringlusse võtta. Märkimisväärselt rohkem puriine laguneb, nii et toodetakse rohkem kusihapet. Neerud ei suuda enam kusihapet täielikult väljutada, põhjustades hüperurikeemiat.
Hüperurikeemia on kusihappe taseme tõus veres. Definitsiooni järgi esineb hüperurikeemia kusihappe sisaldusega 6,5 mg / dl või rohkem. Piirväärtus kehtib võrdselt mõlemast soost. Kusihappe taseme tõusu päästetee katkemise tõttu nimetatakse ka primaarseks hüperurikeemiaks. Ligikaudu 1% kogu hüperurikeemiast on põhjustatud kusihappe ületootmisest puriini metabolismi häirete tõttu. Suurem osa primaarsest hüperurikeemiast põhineb kusihappe vähenenud eritumisel neerudes.
Et eristada, kas suurenenud uriiniväärtused põhinevad vähenenud eritumisel või suurenenud kusihappe tootmisel, tuleb määrata kusihappe kliirens. Kusihappe kliirensi arvutamiseks määratakse ööpäevase uriini kogumisel kusihappe eritumine ja seerumi kusihape.
Enamikul juhtudel jääb hüperurikeemia asümptomaatiliseks. Massiivse hüperurikeemia korral ilmneb podagra äge rünnak. Siin ladestuvad liigestesse kusihappe kristallunud soolad. See viib mõjutatud liigeste põletikuni koos ülekuumenemise, valu ja tugeva punetusega. Eriti sageli on mõjutatud suure varba, hüppeliigese ja põlve metatarsofalangeaalliiges. Kui podagra püsib pikka aega, tehakse kude ümber. Liigese kõhred paksenevad ja areneb nn podagra tophi.
Hüperurikeemiat põhjustav geneetiline defekt on Lesch-Nyhani sündroom. Haigus on päritud X-seotud retsessiivsel viisil ja selle tulemuseks on ensüümi hüpoksantiin-guaniin-fosforibosüültransferaasi (HGPRT) defitsiit. Kuna ensüüm osaleb puriini aluste hüpoksantiini ja guaniini puriini metabolismis, tekib lagundamiseks rohkem puriine. Tulemuseks on kusihappe järsk tõus. Haigus päritakse X-seotud viisil. Seetõttu mõjutab Lesch-Nyhani sündroom peaaegu eranditult mehi. Esimesed sümptomid ilmnevad umbes kümme kuud pärast sündi.
Lastel on märgatav hoiak koos istuva eluviisi ja arenguhäiretega. Esimene märk on mähkmes sageli liigne uriinijääkide hulk. Rasketel juhtudel võivad tekkida ka enesevigastused, näiteks huule- ja sõrmehammustused ning halvenenud mõtlemine. Samuti võivad kannatanud lapsed käituda agressiivselt oma vanemate, õdede-vendade, sõprade või hooldajate suhtes.