Enteropeptidaas on kaksteistsõrmiku limaskesta ensüüm, mille ülesanne on aktiveerida kõhunäärme ensüüme. See seisab seedeensüümide kogu aktiveerimise kaskaadi alguses. Enteropeptidaasi talitlushäired põhjustavad peensooles toidu seedimist ja malabsorptsiooni.
Mis on enteropeptidaas?
Enteropeptidaas on kaksteistsõrmiku limaskesta ensüüm, mis aktiveerib kõhunäärme seedeensüüme, aktiveerides trüpsigeeni trüpsiiniks.
Enteropeptidaas eritub kaksteistsõrmiksoole limaskesta harjapiirdesse. Täpsemalt, sekretsiooni eest vastutavad liebekühni näärmed. Liebekühni näärmed on torukujulised depressioonid peensoole epiteelis. Peensooles asuvad nad peensoole villide vahel. Näärmed, mida tuntakse ka kui Lieberkühni krüptid, sekreteerivad lisaks enteropeptidaasile ka hulgaliselt ensüüme. Enteropeptidaasi sekretsioon stimuleeritakse siis, kui maos eelnevalt seeditud chyme siseneb kaksteistsõrmiksoole. Ainuüksi ensüüm ei mõjuta toidukomponente.
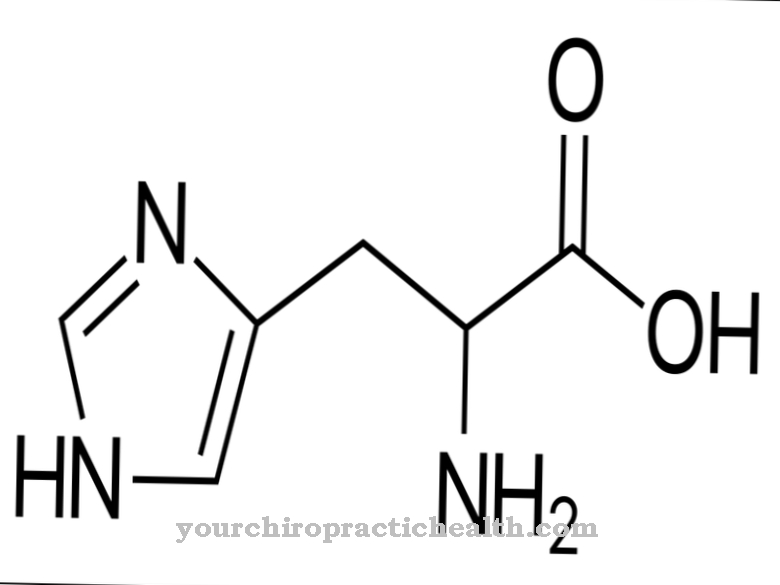
Ainult ensüümi trüpsiini aktiveerimine seob kogu seedeensüümide aktiveerimise kaskaadi. Enteropeptidaas, nagu trüpsiin ja teised kõhunäärme proteaasid, on seriinproteaas. Aktiivne keskus sisaldab asparagiinhappe, histidiini ja seriini katalüütilist triaadi. Endopeptidaasina lõhustab enteropeptidaas valke ainult teatud iseloomulikes punktides aminohappejärjestuses teatud äratundmismotiividega. Ensüüm lõheneb alati Asp-Asp-Asp-Asp-Lys äratundmismotiivi järgi. Trüpsinogeeni abil lõhustatakse heksapeptiid Val- (Asp) 4-Lys, moodustades trüpsiini.
Funktsioon, mõju ja ülesanded
Enteropeptidaasi ülesanne on kõhunäärmes seedeensüümide aktiveerimine. See käivitab alles esimese aktiveerimisetapi koos trüpsinogeeni muundamisega trüpsiiniks.
Trüpsiin on omakorda seriinproteaas, mis lõhustab valke sama iseloomuliku äratundmismotiivi alusel. Nüüd jätkub see trüpsinogeeni enda aktiveerimisega. Samal ajal aktiveerib see pankrease ensüüme nende eellastest nagu kümotrüpsinogeen, pro-elastaas, pro-karboksüpeptidaas, pro-fosfolipaas ja proenteropeptidaas. Ka Enteropeptidaas on esialgu passiivses vormis. Kui toit siseneb kaksteistsõrmiksoole, sekreteeritakse lisaks proenteropeptidaasile ka kaksteistsõrmiksoole, mis aktiveerib enteropeptidaasi tugevust. Pärast aktiveerimise kaskaadi algust võtab trüpsiin üle kõigi kõhunäärme ensüümide, sealhulgas proenteropeptidaasi ja trüpsinogeeni, aktiveerimise.
Proenteropeptidaasi aktiveerimine enteropeptidaasiks toimub veelgi tõhusamalt trüpsiini toimel kui duodenaasi kaudu. Seedeensüümide esmane olemasolu inaktiivsel kujul on äärmiselt oluline. Eriti proteaaside toime on mittespetsiifiline. Kõik valgud, mis sisaldavad iseloomulikku äratundmismotiivi molekulis, lõhustatakse hüdrolüütiliselt. Kui ensüümid oleksid kohe katalüütiliselt aktiivsed, laguneksid keha enda valgud juba kõhunäärmes ja kõhunäärme kanalis. Selle tulemusel lahustuks kõhunääre ise. Aktiveerimine toimub ainult kaksteistsõrmiksooles väljaspool eksokriinseid näärmeid.
Ensüümid võivad siin hakata toidukomponente lagundama, ilma et see ründaks keha enda kudesid. Ensüümide enneaegse aktiveerimise vältimiseks töötab kõhunäärme kanalis täiendav trüpsiini inhibiitor. Seedetrakti kaskaadi võtmerolli mängib aga trüpsiin. Kui see ensüüm on aktiveeritud, ei saa kõigi seedeensüümide, sealhulgas enteropeptidaasi, aktiveerimist peatada.
Haridus, esinemine, omadused ja optimaalsed väärtused
Nagu kõigil seriinproteaasidel, on ka enteropeptidaasil mittespetsiifiline toime ja see lõhustab valke iseloomuliku äratundmismotiivi abil. Enteropeptidaas koosneb kergest ja raskest ahelast, mis on ühendatud disulfiidsildadega. Seriinproteaasi domeen asub kergel ahelal.
Raske ahela molekulmass on 82 kuni 140 kilodaltonit, kerge ahela molekulmass on 35 kuni 62 kilodaltonit. Enteropeptidaasi kerge ahela struktuur sarnaneb teiste seriinproteaaside trüpsiini ja kümotrüpsiiniga. Raske ahel on membraaniga seotud ja mõjutab ensüümi spetsiifilisust. Leiti, et eraldatud kergel ahelal on sarnane toime iseloomuliku äratundmismotiivi - (Asp) 4-Lys- suhtes, kuid oluliselt madalam toime trüpsinogeeni vastu.
Haigused ja häired
Inimese enteropeptidaasi kodeerib ENTK geen 21. kromosoomis. Selle geeni mutatsioon võib mõjutatud lastel põhjustada tõsiseid haigusi.
Ensüüm ei saa enam teisi seedeensüüme aktiveerida. Toidukomponendid ei lagune enam ja seetõttu ei saa need peensooles enam imenduda. See on peamiselt väärindamine (ebapiisav lagunemine), mis põhjustab toidukomponentide imendumist. Keha ei ole enam piisavalt toitainetega varustatud. Esinevad ebaõnnestunud kasv, kännu kasvu ja tüüpilised valguvaeguse sümptomid koos tursega. Samal ajal imenduvad lisaks valkudele ka süsivesikud ja rasvad halvasti. Kuna seedimata toidukomponendid satuvad jämesoolde ja lagunevad seal kääritamise ning putrefaktiivsete bakterite poolt, tekivad ka kõhupuhitus, kõhulahtisus ja kõhuvalu.
Siiani on kogu maailmas kirjeldatud 15 kaasasündinud enteropeptidaasi puudulikkuse juhtu. Kuid haigusseisundi sümptomid on palju tavalisemad. Enteropeptidaasi puudulikkus ei pea alati esinema. Kuna trüpsiinil on seedeensüümide aktiveerimisel võtmeroll, põhjustab trüpsiini puudus või puudus ka sarnaseid sümptomeid. Nende haiguste ravi on mõlemal juhul sama. Ensüüme manustatakse aktiveeritud vormis. Enteropeptidaasi defitsiidi diagnoosimata juhtumeid on kindlasti palju rohkem.
Kui diagnoos on kindel, võib asendada ka enteropeptidaasi. Enteropeptidaasi puudulikkust põhjustavad sekundaarselt ka rasked soolehaigused.Diferentsiaaldiagnostikas tuleks selgitada selliseid haigusi nagu tsöliaakia, lühenenud peensoole, laktaasi puudus või muud.


.jpg)
.jpg)








.jpg)
.jpg)