Aldehüüdoksüdaas on ensüüm, mis lagundab selgroogsetel aldehüüde. Seda võib leida imetajate ja inimeste erinevates kudedes. Aldehüüdoksüdaasi täpne funktsioon pole veel teada.
Mis on aldehüüdoksüdaas?
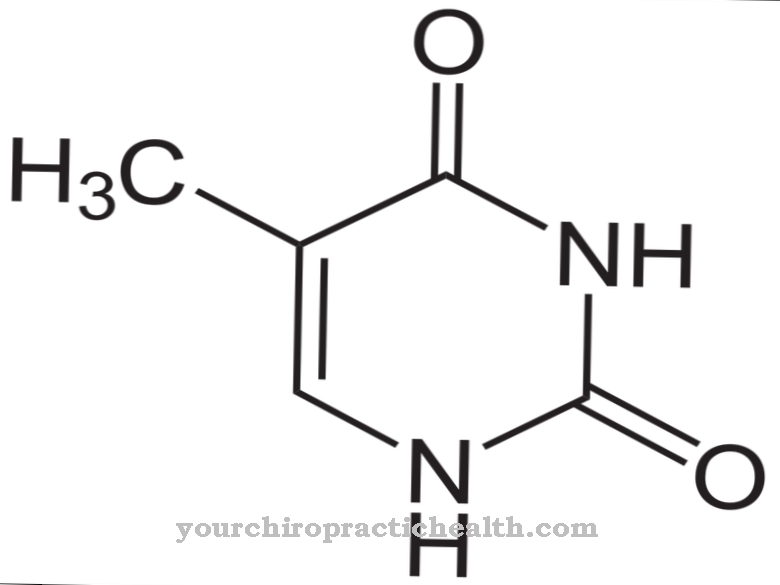
Aldehüüdoksüdaas (AOX1) aitab kehas aldehüüdide ensümaatilist lagunemist. Siiski leiti, et see lagundab ka nikotiini kotiniiniks. Aldehüüdstruktuuri moodustamiseks on hapnikuvabasse nikotiini sisse ehitatud hapnikuaatom.
Selle asjaolu tõttu on aldehüüdi oksüdaas oluline ka trüptofaani metabolismil ja samal ajal ka biotransformatsiooni jaoks. Seda leidub peamiselt maksarakkude, kõhunäärme, kopsude, skeletilihaste või rasvarakkude tsütosoolis. Kofaktor molübdeen on ensüümi aktiivsuse jaoks väga oluline. Inimese DNA-s on ainult üks AOX-geen, mis võib kodeerida funktsionaalset ensüümi. Teistel selgroogsetel on aktiivsed mitmed AOX geenid. Aldehüüdoksüdaas on väga sarnane ensüümi ksantiini dehüdrogenaasiga ja on sellega seotud.
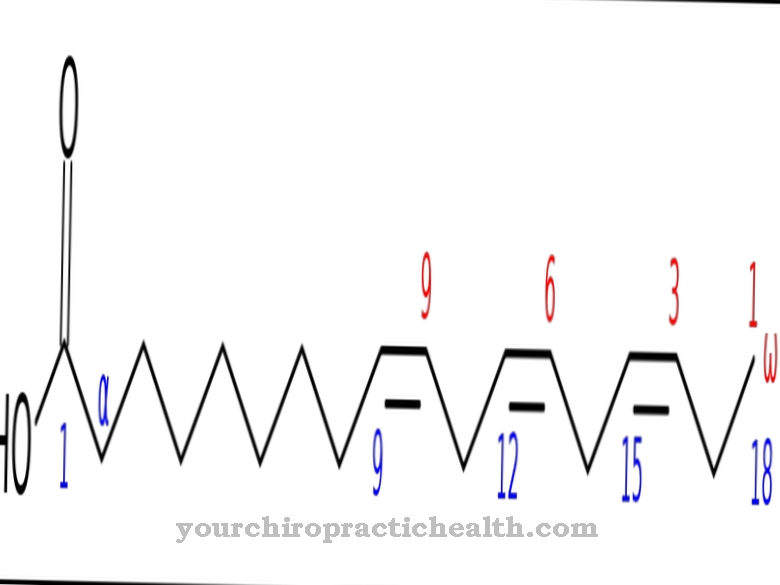
Mõlemad ensüümid võivad muuta hüpoksantiini ksantiiniks, absorbeerides hapnikuaatomit ja veemolekuli. Ksantiini muundamine kusihappeks toimub aga ainult ksantiini hüdrogenaasi (ksantiini oksüdaasi) kaudu. Aldehüüdi oksüdaas koosneb 1338 aminohappest. Molübdopteriin, FAD ja 2 (2Fe2S) toimivad nende efektiivsuse kofaktoritena. Juba nimega reaktsioon iseloomustab aldehüüdide muundamist hapniku ja vee lisamisega karboksüülhapeteks ja vesinikperoksiidiks.
Funktsioon, mõju ja ülesanded
Ensüüm aldehüüdoksüdaas katalüüsib mitmeid reaktsioone. Enamasti vastutab see aldehüüdide muundamise eest karboksüülhapeteks hapniku ja vee lisamisega. Üldiselt vahendab aldehüüdoksüdaas substraadile hapnikuaatomi lisamist.
Muu hulgas katalüüsib see ka nikotiini muundamist konitiiniks. Seetõttu mängib see olulist rolli ka biotransformatsioonis ja trüptofaani metabolismis. Nendes reaktsioonides on kofaktorina alati vajalik molübdeen. Biotransformatsiooni osana muundab see aldehüüdrühmadega ksenobiootikumid vastavateks karboksüülhapeteks I faasi reaktsioonis. II faasi reaktsioonis kinnitatakse karboksüülrühmadele glükuroonhape, et suurendada vees lahustuvust, et võõras molekul kehast välja voolata.
Struktuurselt ja keemiliselt on aldehüüdoksüdaas tihedalt seotud homoloogse ensüümi ksantiini hüdrogenaasiga (ksantiini oksüdaas). Kuid pole teada, miks ainult ksantiini oksüdaas katalüüsib ksantiini muutumist kusihappeks hapniku ja vee lisamisega. Mõlemad ensüümid katalüüsivad endiselt hüpoksantiini muundamist ksantiiniks. Lisaks on aldehüüdoksüdaas vastutav ka adipogeneesi (rasvarakkude paljunemise) eest.
See stimuleerib kudede hormooni adiponektiini sekretsiooni. Adiponektiin suurendab omakorda insuliini efektiivsust. Hepatotsüütides pärsib adiponektiin omakorda aldehüüdi oksüdaasi vabanemist. Aldehüüdoksüdaasi (AOX1) puudus pärsib ka lipiidide eksporti rakkudest. Aldehüüdoksüdaasi täpne funktsioon pole veel täielikult teada.
Haridus, esinemine, omadused ja optimaalsed väärtused
Aldehüüdoksüdaasi leidub peamiselt maksarakkude tsütoplasmas. Kuid seda leidub ka rasvarakkudes, kopsukoes, skeletilihastes ja kõhunäärmes. Varem oli see segane homoloogse ksantiinoksüdaasiga.
Mõlemal ensüümil on sarnane struktuur. Kuid need katalüüsivad mõnikord erinevaid reaktsioone. Mõlemad ensüümid vajavad oma funktsiooniks samu kofaktoreid. Need on molübdopteriin, FAD ja 2 (2Fe2S). Kuid mitte ainult ei lagunda aldehüüdoksüdaas aldehüüde, vaid vastutab ka N-heterotsükliliste ühendite nagu nikotiini oksüdeerimise eest kotiniiniks.
Haigused ja häired
Koos ksantiindehüdrogenaasi (ksantiinoksüdaasi) ja sulfitioksüdaasiga sõltub aldehüüdoksüdaas kofaktorist molübdeenist. Molübdeen on sisse ehitatud keeruka aatomina molübdopteriiniks ja moodustab molübdeeni kofaktori. Molübdeeni defitsiidi korral toimivad need kolm ensüümi halvasti.
Ksantiini dehüdrogenaas katalüüsib ksantiini lagunemist kusihappeks. Ensüüm aldehüüdoksüdaas osaleb selles protsessis ainult osaliselt, näiteks siis, kui hüpoksantiin jaotatakse ksantiiniks. Siin konkureerib see isegi ksantiinoksüdaasiga. Seega puudub isoleeritud aldehüüdi oksüdaasi defitsiit. Aldehüüdoksüdaas toetab aga katehhoolamiinide lagunemist. Väävlit sisaldavate aminohapete nagu tsüsteiin, tauriin või metioniin lagunemise eest vastutab sulfitoksüdaas. Selle ensüümi puudulikkuse korral ei muundata sulfiti enam sulfaadiks. Kofaktori molübdeeni tõttu on neil kolmel ensüümil tavaliselt ühine puudus.
Muidugi on kõigi nende ensüümide puhul võimalik mutatsioonidest tingitud isoleeritud defekte. Spetsiifilise aldehüüdi oksüdaasi puudulikkusega kliinilisi pilte pole siiani siiski kirjeldatud. Tasakaalustamata toitumisest põhjustatud molübdeeni defitsiit on väga harv nähtus. Kuid see võib juhtuda parenteraalse toitumisega, mille molübdeeni sisaldus on madal rohkem kui kuus kuud. Sellistel juhtudel on tavaline tahhüpnea, tahhükardia, tugev peavalu, iiveldus, oksendamine, näo keskseisus või kooma. Lisaks on teatud aminohapete talumatus. Kõrgenenud sulfitisisaldus on uriinis, vähenenud kusihappe sisaldus aga veres.
Kui molübdeeni defitsiit püsib, võib see põhjustada väävlit sisaldavate aminohapete lagunemise probleeme, sulfitiallergiaid, juuste väljalangemist, madala kusihappe sisalduse taset veres ja viljakuse probleeme. Enamik sümptomeid on aga tingitud sulfitioksüdaasi ja ksantiini dehüdrogenaasi puudulikkusest. Tahhükardia on tõenäoliselt tingitud adrenaliini või noradrenaliini (katehhoolamiinide) taseme tõusust, kuna nende lagunemine viib aldehüüdoksüdaasi puudumise tõttu edasi. Molübdeeni defitsiiti võib põhjustada dieet, milles on eriti vähe molübdeeni, ja põletikulised soolehaigused, näiteks Crohni tõbi koos toidu imendumishäiretega.
Päriliku molübdeeni kofaktori defitsiit molübdopteriini häiritud sünteesi tõttu on saatuslik, kui kõik kolm ensüümi ravitavad.

.jpg)