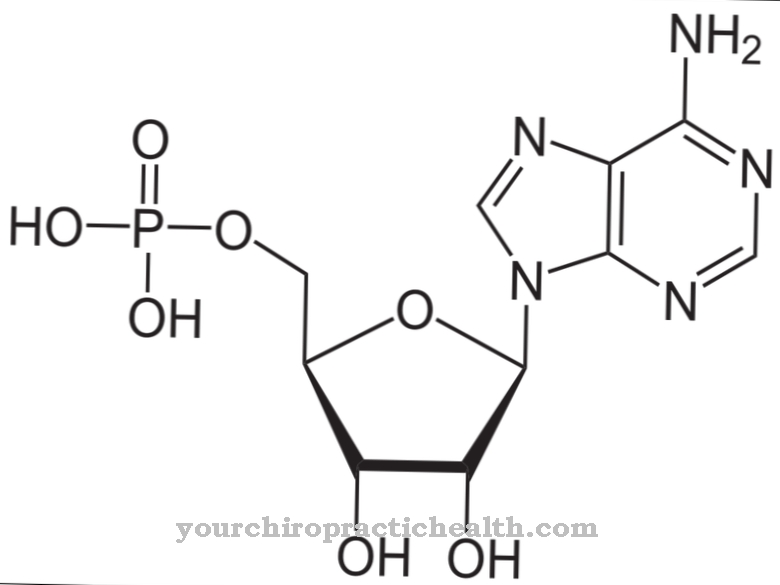
Adenosiindifosfaat (ADP) on puriini aluse adeniiniga mononukleotiid ja mängib keskset rolli kõigis metaboolsetes protsessides. Koos adenosiintrifosfaadiga (ATP) vastutab see organismi energiavahetuse eest. Enamik ADP funktsiooni häireid on mitokondriaalsed.
Mis on adenosiindifosfaat?
Mononukleotiidina koosneb adenosiindifosfaat puriini aluse adeniinist, suhkru riboosist ja kaheosalisest fosfaatide ahelast. Kaks fosfaatjääki on üksteisega seotud anhüdriidsideme kaudu. Täiendava fosfaatjäägi imendumisel tekib energiatarbimise ajal adenosiintrifosfaat (ATP).
ATP on omakorda organismi keskne energiavaru ja energiakandja. Energiat tarbivate protsesside korral eraldatakse ka kolmas fosfaatjääk, mille käigus moodustub taas madalama energiaga ADP. Kuid kui ADP vabastab fosfaatjäägi, loob see adenosimonofosfaadi (AMP). AMP on ribonukleiinhappe mononukleotiid. ADP saab moodustada ka AMP-st fosfaatjäägi omastamise teel. See reaktsioon nõuab ka energiat. Mida rohkem fosfaatide jääke mononukleotiid sisaldab, seda energilisem see on.
Fosfaadijääkide negatiivne laeng tihedalt pakitud ruumis põhjustab tõrjuvaid jõude, mis destabiliseerivad eriti kõige fosfaadirikkamat molekuli (ATP). Magneesiumioon võib pinget jaotades molekuli mõnevõrra stabiliseerida. Veelgi tõhusam stabiliseerimine saavutatakse tänu ADP regressioonile fosfaatjäägi vabastamisega. Vabanenud energiat kasutatakse kehas energeetilisteks protsessideks.
Funktsioon, mõju ja ülesanded
Kuigi adenosiindifosfaati varjutab adenosiintrifosfaat (ATP), on sellel sama suur tähtsus organismil. ATP-d nimetatakse elu molekuliks, kuna see on kõigis bioloogilistes protsessides kõige hädavajalikum energiakandja. Kuid ATP mõju ei saa ilma ADPta seletada.
Kõik reaktsioonid sõltuvad ATP-s oleva kolmanda fosfaatjäägi ja teise fosfaadijäägi vahelisest suure energiasisaldusega sidemest. Fosfaatjäägi eraldumine toimub alati energiat tarbivate protsesside ja muude substraatide fosforüülimise ajal. ADP luuakse ATP-st. Kui fosforüülimisega energeetiliselt aktiveeritav substraadimolekul kannab oma fosfaadijäägid tagasi ADP-sse, tekib energiarikkam ATP. Seetõttu tuleks ATP / ADP süsteemi tegelikult tervikuna arvestada.
Selle süsteemi toimel sünteesitakse uusi orgaanilisi aineid, viiakse läbi osmootiline töö, ained transporditakse aktiivselt läbi biomembraani ja lihaste kokkutõmbumise ajal toimub isegi mehaaniline liikumine. Lisaks mängib ADP paljudes ensümaatilistes protsessides oma rolli. See on osa koensüümist A. Koensüümina toetab koensüüm A energia metabolismis paljusid ensüüme. Seega osaleb see rasvhapete aktiveerimises.
See koosneb ADP-st, B5-vitamiinist ja aminohappest tsüsteiinist. Koensüüm A mõjutab otseselt rasvade metabolismi ning kaudselt süsivesikute ja valkude metabolismi. ADP mängib rolli ka vere hüübimisel. Vereliistakute teatud retseptoritega kinnitumisel stimuleerib ADP trombotsüütide suurenenud agregatsiooni ja tagab seeläbi haavade veritsemise kiirema paranemise.
Haridus, esinemine, omadused ja optimaalsed väärtused
Adenosiindifosfaat ilmneb selle suure tähtsuse tõttu kõigis organismides ja kõigis rakkudes. Selle peamine tähtsus koos ATP-ga on energiat edastavate protsesside jaoks. ATP ja seega ka ADP esinevad suurtes kogustes eukarüootide mitokondrites, kuna seal toimuvad hingamisahela protsessid. Bakterites asuvad nad muidugi tsütoplasmas.
ADP toodetakse algselt fosfaatjäägi lisamisega adenosiinmonofosfaadile (AMP). AMP on RNA mononukleotiid. Biosünteesi lähtepunktiks on riboos-5-fosfaat, mis seob erinevate vaheetappide kaudu teatud aminohapete molekulirühmi, kuni moodustub mononukleotiidne inositoolmonofosfaat (IMP). Lisaks GMP-le moodustatakse AMP lõppkokkuvõttes edasiste reaktsioonide kaudu. AMP-d saab nukleiinhapetest taastada ka päästetee kaudu.
Ravimid leiate siit
Fatigue Väsimuse ja nõrkuse ravimidHaigused ja häired
Häired ATP / ADP süsteemis esinevad peamiselt nn mitokondriaalsete haiguste korral. Nagu nimigi ütleb, on need mitokondrite haigused. Mitokondrid on rakuorgaanid, milles suurem osa energiat tootvatest protsessidest toimub hingamisahela kaudu.
Siin lagunevad energia moodustamisel süsivesikute, rasvade ja valkude ehitusplokid. ATP ja ADP on nendes protsessides keskse tähtsusega. On leitud, et mitokondriaalse haiguse korral on ATP kontsentratsioon madalam. Põhjused on mitmesugused. Geneetilised põhjused võivad häirida ATP teket ADP-st. Kõigist võimalikest geneetilistest haigustest leiti tugevalt energiast sõltuvate elundite eriline kahjustus. Sageli on mõjutatud süda, lihasüsteem, neerud või närvisüsteem. Enamik haigusi progresseerub kiiresti, ehkki haigusprotsess on inimestel erinev.
Erinevused võivad olla tingitud mõjutatud mitokondrite erinevast arvust. Samuti on võimalik omandada mitokondriaalsed haigused. Mitokondriaalse funktsiooni häiretega on seotud ka sellised haigused nagu suhkurtõbi, rasvumine, ALS, Alzheimeri tõbi, Parkinsoni tõbi või vähk. Keha energiavarustus on halvenenud, mis omakorda põhjustab tugevalt energiast sõltuvate elundite edasist kahjustamist.
Kuid ADP-l on lisaks energia ülekandmisprotsessidele ka mõned olulised funktsioonid. Selle mõju verehüübimisele võib põhjustada verehüüvete tekkimist ka soovimatutes kohtades. Tromboosi, insuldi, südameataki või emboolia vältimiseks võib riskirühma kuuluvate inimeste vedel lahjendada või ADP pärssida. ADP inhibiitorite hulka kuuluvad ravimid klopidogreel, tiklopidiin ja prasugreel.

.jpg)