Fibronektiin on glükoproteiin ja mängib olulist rolli keharakkude koos hoidmisel või vere hüübimisel. See võtab organismis palju erinevaid funktsioone, mis on seotud tema võimega arendada kleepuvaid jõude. Fibronektiini struktuuri struktuurilised vead võivad põhjustada sidekoe tugevat nõrkust.
Mis on fibronektiin?
Fibronektiin on glükoproteiin molekulmassiga 440 kDa (kilodaltonid). Seda kasutatakse kleepuvate jõudude arendamiseks rakkude vahel, keharakkude ja mitmesuguste substraatide vahel, keharakkude ja rakkudevahelise maatriksi vahel ning vereliistakute vahel vere hüübimise ajal. Seetõttu toetab see haavade paranemist, embrüogeneesi, hemostaasi, raku adhesiooni raku migratsiooni ajal või antigeeni sidumist fagotsüütidega.
Primaarne fibronektiin sisaldab 2355 aminohapet ja moodustab 15 isovormi. See esineb nii rakuvälises piirkonnas kui ka keharakkudes. Väljaspool rakke on see lahustumatu valk, raku plasmas lahustuv valk. Kõik fibronektiini vormid on kodeeritud sama FN1 geeni poolt. Lahustuv fibronektiin sisaldab kahte isomeerset valguahelat, mis on ühendatud disulfiidsillaga. Lahustumatu fibronektiini korral ühendatakse need molekulid jälle disulfiidsildade kaudu, moodustades fibrillitaolise struktuuri.
Anatoomia ja struktuur
Oma põhistruktuuris on fibronektiin heterodimeer, mis koosneb kahest vardakujulisest valguahelast, mis on ühendatud disulfiidsillaga. Isomeerseid valguahelaid ekspresseerib sama geen, FN1 geen. Erinev alusjärjestus tuleneb selle geeni alternatiivsest splaissimisest. Iga geen sisaldab eksoone ja introneid. Eksonid on sektsioonid, mis tõlgitakse valgu struktuuriks. Intronid on seevastu passiivsed geenisegmendid. Alternatiivse splaissingu korral jääb aluspaaride järjestus samaks, kuid eksone ja introne leidub erinevates geenisegmentides. Geneetilise teabe tõlkimisel liidetakse loetavad eksonid ja intronid lõigatakse välja. Sama geneetilise teabe alternatiivne translatsioon võimaldab moodustada samast geenist mitu isomeerset valguahelat.
Fibronektiin, mis koosneb kahest isomeersest valguahelast, on lahustuv, moodustub maksas ja siseneb vereplasmasse. Seal vastutab see vere hüübimise eest haavade paranemise ja kudede uuendamise osana. Lahustumatut fibronektiini toodetakse makrofaagides, endoteelirakkudes või fibroblastides. See sisaldab sama põhistruktuuri. Kuid siin ühendatakse üksikud fibronektiini molekulid omakorda üksteisega disulfiidsildadega, moodustades fibrillaarsed valgu struktuurid, mis hoiavad rakke koos.
Liimimisjõudude arendamise võime tuleneb sageli esinevast aminohappejärjestusest arginiinist - glütsiinist - aspartaadist. See viib fibronektiini adhesioonini niinimetatud integriinidega (adhesiooniretseptorid rakkude pinnal). Fibronektiini valguahelad koosnevad paljudest domeenidest, mis sisaldavad 40 kuni 90 aminohapet. Domeenide homoloogia tõttu jagunevad fibronektiini polüpeptiidahelad kolmeks struktuuritüübiks I, II ja III.
Funktsioon ja ülesanded
Fibronektiin toimib üldiselt teatud struktuuriüksuste koos hoidmiseks. Nende hulka kuuluvad rakud, rakuväline maatriks, teatud substraadid või isegi vereliistakud. Fibronektiini nimetati varem Rakuliim määratud. See tagab, et kudede rakud püsiksid koos ja ei triiviks.
Samuti mängib see suurt rolli rakkude migratsioonil. Isegi makrofaagide dokkimist antigeenidega vahendab fibronektiin. Lisaks kontrollib fibronektiin paljusid embrüogeneesi ja rakkude diferentseerumise protsesse.
Kuid pahaloomulistes kasvajates väheneb fibronektiin sageli. See võimaldab kasvajal kasvada koesse ja moodustada metastaase, eraldades kasvajarakud.
Vereplasmas lahustuv fibronektiin võimaldab verehüüvete moodustumisel veritsevate haavade sulgemiseks. Üksikud vereliistakud liimitakse kokku fibriini moodustumise teel. Opsoniinina seostub fibronektiin retseptoritena makrofaagide pinnaga. Nende retseptorite abil saavad makrofaagid teatud haiguse põhjustavaid osakesi siduda ja neisse lisada. Rakuvälises ruumis vastutab rakke fikseeriva maatriksi moodustumise eest lahustumatu fibronektiin.
Haigused
Fibronektiini puudusel või struktuurihälvetel on sageli tõsised tervisemõjud. Vähi kasvu tagajärjel kasvajas langeb fibronektiini kontsentratsioon. Tuumori rakustruktuur lõtvub ja rakud liiguvad lahku. See põhjustab kasvajarakkude lagunemisest ja rändest lümfisüsteemi või vereplasma kaudu muudesse kehaosadesse sagedasi metastaase. Lisaks võivad vähirakud fibronektiini puudumise tõttu kiiremini naabruses asuvasse koesse kasvada ja niiviisi seda välja tõrjuda.
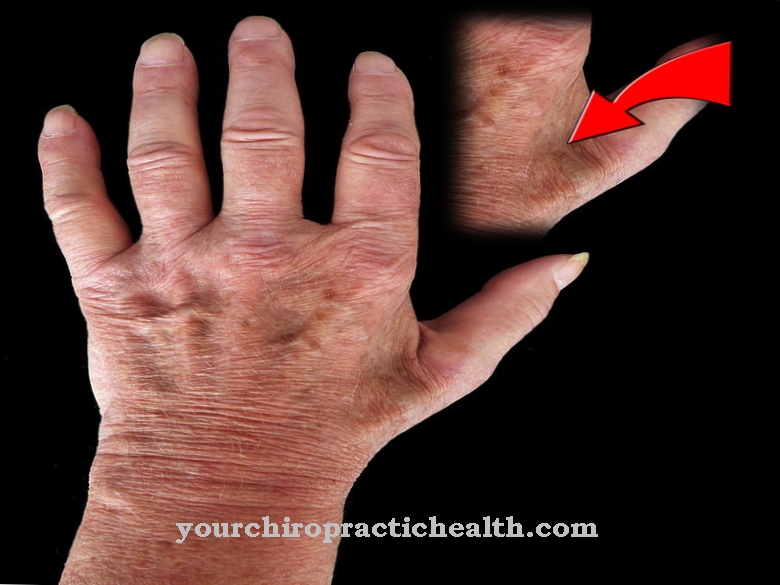
Lisaks sellele on pärilikke haigusi, mis põhjustavad sidekoe defekti. Üks näide on Ehlers-Danlos sündroom. Ehlers-Danlosi sündroom ei ole ühtne haigus, vaid kujutab endast pigem sidekoe defektide kompleksi.Tüüp X on põhjustatud puuduvast või puudulikust fibronektiinist. See on FN1 geeni mutatsioon. See toob kaasa sidekoe järsu nõrkuse. Tingimus on päritud autosomaalse retsessiivse tunnusena. See avaldub väga longus nahas ja liigeste liigsuses. Vaatamata nõrkade sidekoe põhjustaja suurtele erinevustele on selle kompleksi üksikute haiguste sümptomid sarnased. Taani dermatoloogi Edvard Ehlersi ja prantsuse dermatoloogi Henri-Alexandre Danlosi sõnul on Ehlers-Danlosi sündroomi kardinaalseteks sümptomiteks naha tugev üle pingutus ja pingutatavus.
Lõpuks võib teatud mutatsioon FN1 geenis põhjustada ka glomerulopaatiat (neerurakkude haigused). See on tõsine neeruhaigus, mis nõuab sageli dialüüsravi.